Modelo Atomico de Bohr
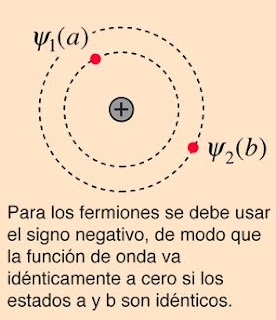
El Modelo Atómico de Bohr (1913) postula que: 1. Los electrones describen órbitas circulares estables alrededor del núcleo del átomo sin radiar energía. 2. Los electrones solo se pueden encontrar en ciertas órbitas (no todas las órbitas están permitidas) . La ditancia de la órbita al núcleo se determina según el número cuántico n (n=1, n=2, n=3...): radio de la órbita (en Ångströms) → r = 0,529 · n2 3. Los electrones solo emiten o absorben energía en los saltos entre órbitas . En dichos saltos se emite o absorbe un fotón cuya energía es la diferencia de energía entre ambos niveles determinada por la fórmula: Ea - Eb = h · v = h · (RM · [1/nb2 - 1/na2] Imagen tomada de: http://www.quimicas.net/2015/05/el-modelo-atomico-de-bohr.html El Modelo Atómico de Bohr explica las insuficiencias del Modelo Atómico de Rutherford sobre la estabilidad de las órbitas del electrón y la existencia de espectros de emisión característicos. El modelo de Bohr incorpora ta