Principio de Exclusion de Pauli
Dos electrones en un átomo no pueden tener idéntico número cuántico. Este es un ejemplo de un principio general que se aplica no sólo a los electrones, sino también a otras partículas de espín medio-entero (fermiones). No se aplica a partículas de espín entero (bosones).
 |
| imagen tomada de: http://hyperphysics.phy-astr.gsu.edu/hbasees/pauli.html |
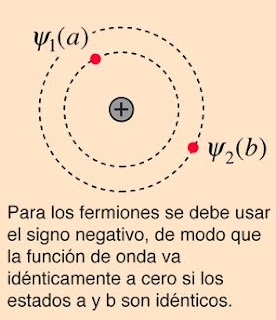
La naturaleza del principio de exclusión de Pauli se puede ilustrar mediante la suposición de que los electrones 1 y 2 están en los estados a y b respectivamente. La función de onda para el sistema de dos electrones sería
 |
| imagen tomada de: http://hyperphysics.phy-astr.gsu.edu/hbasees/pauli.html |
pero esta función de onda no es aceptable porque los electrones son idénticos e indistinguibles. Para tener en cuenta esto, se debe utilizar una combinación lineal de las dos posibilidades, ya que no es posible determinar cual electrón está en cual estado.
La función de onda para el estado, en el que son ocupados por los electrones los dos estados "a" y "b", se pueden escribir
 |
| imagen tomada de: http://hyperphysics.phy-astr.gsu.edu/hbasees/pauli.html |
El principio de exclusión de Pauli es parte de una de nuestras observaciones más básicos de la naturaleza: las partículas de espín semientero, debe tener funciones de onda antisimétricas, y las partículas de espín entero debe tener funciones de onda simétricas. El signo menos en la relación anterior obliga a la función de onda a desaparecer, si ambos estados son "a" o "b", lo que implica que es imposible que dos electrones ocupen el mismo estado.
Bibliografía;
La información fue tomada el día: 28/06/2017
De las páginas: http://hyperphysics.phy-astr.gsu.edu/hbasees/pauli.html

Comentarios
Publicar un comentario